Pourquoi utiliser des virus pour soigner des plantes malades ?
Posté : 20 mai 2020 / Mis-à-jour : 7 avril 2024
Temps de lecture : 9 minutes
Tout comme les humains et les autres animaux, les plantes sont aussi susceptibles de tomber malades [1]. Loin d’être anecdotiques, ces maladies peuvent être un fléau pour l’agriculture et conduire à des famines lorsqu’elles frappent à grande échelle. Les dégâts causés par ces maladies peuvent se chiffrer en plusieurs dizaines de milliers d’euros par hectare touché.
Micro-organismes phytopathogènes
Les micro-organismes responsables de ces maladies sont appelés phytopathogènes. Ceux-ci sont principalement des mycètes mais aussi des bactéries et des virus. Les maladies et symptômes sont aussi divers que les organismes responsables de leur apparition. Les symptômes sont souvent visibles sur les feuilles et correspondent généralement à une modification de sa couleur ou de sa forme. Cela peut conduire à une diminution de la photosynthèse au niveau des feuilles.
Les dégâts infligés ne se limitent pas aux feuilles et peuvent s’étendre au reste de la plante. Là aussi ils sont assez divers et peuvent prendre la forme de la mort des cellules végétales (par des toxines), une perte de rigidité (flétrissement), une croissance cellulaire incontrôlée (tumeur) ou conduire à un blocage des vaisseaux transportant la sève. De façon générale, cela se traduit par des plantes plus petites (nanisme) et une perte de récolte.

Transmission des phytopathogènes
Les plantes ne peuvent pas se déplacer pour propager les phytopathogènes. Leur transmission d’une plante à une autre est donc souvent réalisée par un organisme vecteur tel qu’un insecte ou un nématode. Les activités humaines comme que l’agriculture ou l’utilisation d’outils ayant été contaminés sont d’autres sources de transmission. Les conditions météorologiques comme le vent ou la pluie interviennent aussi dans la transmission.

Pseudomonas syringae une bactérie qui s’attaque aux plantes
Pseudomonas syringae (P. syringae) est l’une des principales espèces de bactéries infectant les plantes [2 ; 3 ; 4]. Derrière le nom de cette bactérie, se regroupent plusieurs souches très proches mais infectant des plantes différentes. On parle de pathovars (pv.) pour désigner ces bactéries phytopathogènes proches. Plus de 60 pathovars ont été décrits pour P. syringae et peuvent infecter des plantes d’intérêts agricoles et alimentaires [5].
– Pseudomonas syringae pv. maculicola -> infecte le chou-fleur
– Pseudomonas syringae pv. avi -> infecte le cerisier
– Pseudomonas syringae pv. tomato DC3000 -> infecte la tomate
– Pseudomonas syringae pv. actinidiae -> infecte le kiwi
– Pseudomonas syringae pv. lapsa ATCC 10859 -> infecte le blé
Cette bactérie est transportée par le vent, la pluie ou des insectes. Elle profite des branches et des fruits endommagés par la pluie ou la grêle pour infecter la plante. Une fois à l’intérieur de la plante, P. syringae se développe et conduit à l’apparition de lésions pouvant être fatales pour la plante.
Comment soigner des plantes ?
Les moyens de lutter contre P. syringae et les autres bactéries phytopathogènes sont rares. De façon préventive, ils consistent en des épandages de bouillie bordelaise (oxyde de cuivre ; Cu2O) ou d’antibiotiques. Ces méthodes ne sont pas spécifiques d’un pathogène et ont un effet sur de nombreuses bactéries qu’elles soient néfastes ou bénéfiques pour la plante. De plus elles posent des problèmes de résistance chez les bactéries ainsi que la présence de résidus (d’oxyde de cuivre ou d’antibiotiques) sur les fruits et légumes destinés à la consommation humaine.
Une autre approche, en cours de développement, consiste à utiliser des virus infectant uniquement les bactéries selon l’adage « Les ennemis de mes ennemis sont mes amis ». Ces virus sont appelés bactériophages ou bactériovirus. Les traitements avec les bactériophages permettent de cibler spécifiquement une espèce de bactérie à éliminer. Cette spécificité présente l’avantage de ne pas affecter les autres bactéries présentes et notamment celles qui peuvent avoir un rôle positif pour les plantes.

Bactériophages, des tueurs de bactéries
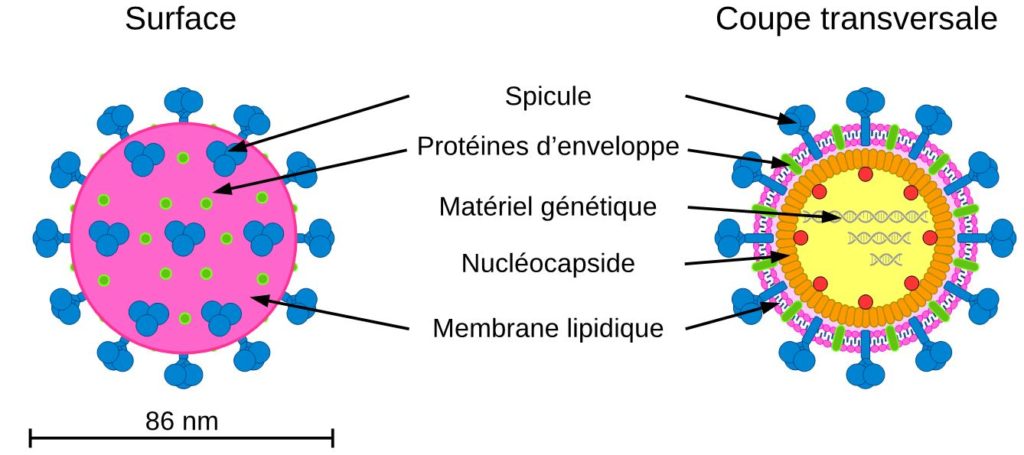
Les bactériophages sont des micro-organismes retrouvés abondamment dans la nature [7]. Des estimations indiquent qu’ils seraient même 10 fois plus nombreux que les bactéries dans l’environnement. Ces organismes possèdent un matériel génétique (ADN ou ARN) protégé par des protéines qui forment une « coque protectrice » appelée capside.

Ces virus ne possèdent pas la machinerie cellulaire nécessaire à leur réplication et ne peuvent donc pas se multiplier tout seuls. Ils ont besoin de détourner la machinerie cellulaire des bactéries pour se multiplier. Les virus sont donc des parasites dépendant d’une cellule à infecter pour se répliquer. Les bactériophages sont des virus inoffensifs pour les humains car la machinerie cellulaire des cellules humaines est très différente de celle des bactéries et qu’ils ne peuvent pas la détourner.

Bactériophage phi6 (φ6)
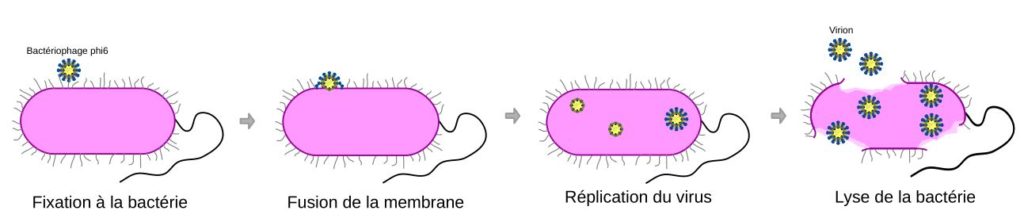
Le virus utilisé dans cette étude est le bactériophage φ6 qui a été isolé en 1973 chez une souche de Pseudomonas phytopathogène [8 ; 9]. Le bactériophage phi6 est dit « lytique » car il conduit à la lyse de la membrane bactérienne ce qui tue la bactérie.
Ce virus se fixe à la surface des bactéries puis sa membrane lipidique fusionne avec celle de la bactérie pour faire rentrer la capside. La machinerie cellulaire de la bactérie est ensuite détournée pour produire de nouveaux virus (appelés virions). Une fois que les virions ont été produits, la membrane de la bactérie est détruite (lysée) ce qui permet aux virions d’être libérés. Ils pourront ensuite infecter d’autres bactéries à leur tour.
Méthode pour tester l’efficacité de ce bactériophage
Avant de tester l’efficacité de ce bactériophage dans des champs agricoles, il est testé in vitro en laboratoire. Cela permet de réaliser l’expérience dans un environnement contrôlé et ainsi d’obtenir des résultats plus faciles à interpréter. L’efficacité de ce virus est testée en réalisant l’infection de bactéries dans plusieurs conditions de cultures.
Pour déterminer l’efficacité du virus, il est quantifié après avoir été cultivé avec des bactéries dans plusieurs conditions de culture. La méthode utilisée pour quantifier le virus est appelée plaque de lyse. Pour cela, on utilise une gélose sur laquelle des bactéries se sont développées sur toute la surface. On parle de tapis bactérien pour indiquer que toute la gélose est recouverte de bactéries. On ajoute ensuite le bactériophage sur le tapis bactérien. La lyse des bactéries par le bactériophage va conduire à l’apparition de « trous » dans le tapis bactérien. Ces zones où les bactéries ont été lysées sont appelés plaque de lyse. En comptant les plaques de lyses obtenus, il est possible de calculer combien de virus sont présents dans l’échantillon.
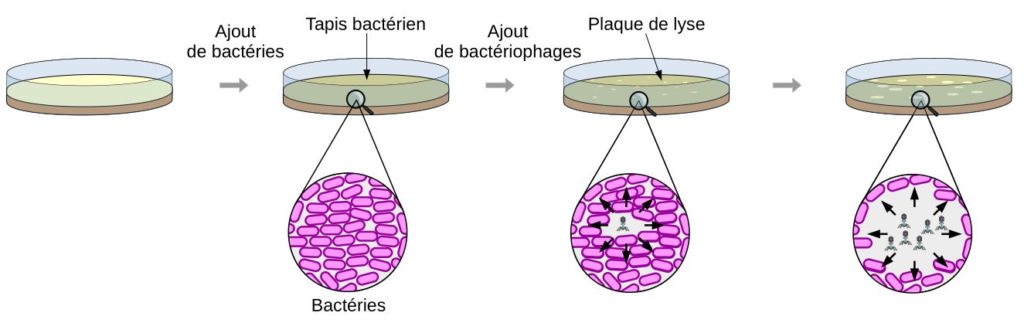
Résultats de l’étude
Le bactériophage phi6 est capable d’infecter deux pathovars de P. syringae : Pseudomonas syringae pv. syringae et Pseudomonas syringae pv. actinidiae mais n’affecte pas d’autres bactéries comme Pseudomonas putida ou Escherichia coli. Cela prouve la spécificité de ce traitement.
Plusieurs conditions d’infections sont testées pour déterminer celles optimales dans l’environnement. Des modifications légères de l’acidité (pH de 6,5 à 7,5) ne conduisent pas à des différences d’efficacité. Par contre, une température trop élevée (37 °C) ou des rayons ultraviolets (UV-B et C ; longueur d’onde de 90 à 320 nm) réduisent la viabilité du virus et donc son efficacité. Les infections des plantes par P. syringae ont lieu surtout l’automne et l’hiver, les températures élevées ne devraient donc pas limiter cette approche. Pour éviter une perte d’efficacité à cause des rayons UV, le traitement pourrait donc avoir lieu en soirée ou de nuit.

Perspectives de l’étude
Cette étude ouvre de nouvelles pistes pour lutter contre des bactéries nuisibles à l’agriculture. Des études sur le terrain devront suivre pour confirmer l’efficacité de ce type de traitement.
Les bactériophages sont de plus en plus étudiés, notamment en santé humaine pour lutter contre les bactéries devenues multi-résistantes aux antibiotiques. L’agriculture s’ajoute à la liste des domaines où ils pourraient être utilisés.
Référence de l’étude
Pinheiro, L. A. M., Pereira, C., Frazão, C., Balcão, V. M., & Almeida, A. (2019). Efficiency of phage φ6 for biocontrol of Pseudomonas syringae pv. syringae: An in vitro preliminary study. Microorganisms, 7(9), 286. doi:10.3390/microorganisms7090286 (lien)
Pour plus d’informations
[1] Burkholder, W. H. (1948). Bacteria as plant pathogens. Annual Review of Microbiology, 2(1), 389–412. doi:10.1146/annurev.mi.02.100148.002133 (lien)
[2] Mansfield, J., Genin, S., Magori, S., Citovsky, V., Sriariyanum, M., Ronald, P., Dow, M., Verdier, V., Beer S. V., Machado, M. A., Toth, I., Salmond, G., & Foster, G. D. (2012). Top 10 plant pathogenic bacteria in molecular plant pathology. Molecular Plant Pathology, 13(6), 614–629. doi:10.1111/j.1364-3703.2012.00804.x (lien)
[3] Xin, X.-F., Kvitko, B., & He, S. Y. (2018). Pseudomonas syringae: What it takes to be a pathogen. Nature Reviews Microbiology, 16(5), 316–328. doi:10.1038/nrmicro.2018.17 (lien)
[4] Donati, I., Buriani, G., Cellini, A., Mauri, S., Costa, G., & Spinelli, F. (2014). New insights on the bacterial canker of kiwifruit (Pseudomonas syringae pv. actinidiae). Journal of Berry Research, 4(2), 53–67. doi:10.3233/jbr-140073 (lien)
[5] Bull, C. T., Coutinho, T. A., Denny, T. P., Firrao, G., Le Saux, M., Li, G., Saddler, G. S., Scortichini, M., Stead, D. E., Takikawa, Y., (2014). List of new names of plant pathogenic bacteria (2011-2012). Journal of Plant Pathology, Springer, 96 (2), pp.223-226. doi:10.4454/JPP.V96I2.026 (lien)
[6] Żaczek, M., Weber-Dąbrowska, B., & Górski, A. (2014). Phages in the global fruit and vegetable industry. Journal of Applied Microbiology, 118(3), 537–556. doi:10.1111/jam.12700 (lien)
[7] Salmond, G. P. C., & Fineran, P. C. (2015). A century of the phage: Past, present and future. Nature Reviews Microbiology, 13(12), 777–786. doi:10.1038/nrmicro3564 (lien)
[8] Vidaver, A.K., Koski, R. K., & Van Etten, J. L. (1973) Bacteriophage φ6: A Lipid-containing virus of Pseudomonas phaseolicola. Journal of Virology. 11 (5) 799-805 (lien)
[9] Poranen, M. M., & Tuma, R. (2004). Self-assembly of double-stranded RNA bacteriophages. Virus Research, 101(1), 93–100. doi:10.1016/j.virusres.2003.12.009 (lien)
Gross, J. (2016). Chemical communication between phytopathogens, their host plants and vector insects and eavesdropping by Natural Enemies. Frontiers in Ecology and Evolution, 4. doi:10.3389/fevo.2016.00104 (lien)
Gonella, E., Tedeschi, R., Crotti, E., & Alma, A. (2019). Multiple guests in a single host: interactions across symbiotic and phytopathogenic bacteria in phloem-feeding vectors – a review. Entomologia Experimentalis et Applicata. doi:10.1111/eea.12766 (lien)
Roossinck, M. J. (2015). Plants, viruses and the environment: Ecology and mutualism. Virology, 479-480, 271–277. doi:10.1016/j.virol.2015.03.041 (lien)







1 Commentaire