Utiliser des abeilles pour transporter des bactéries ?
Posté : 12 juin 2020 / Mis-à-jour : 7 avril 2024
Temps de lecture : 6 minutes
Les bactéries dites phytopathogènes sont capables d’infecter les plantes et de causer des dommages aux cultures. D’autres bactéries au contraire ont un rôle positif pour les plantes et aident à la défense des végétaux contre des phytopathogènes. Certaines de ces bactéries bénéfiques sont commercialisées sous forme de produits phytosanitaires (équivalent d’un médicament pour une plante). Un problème se pose : comment apporter les bactéries aux plantes ? Les protocoles traditionnels utilisent des sprays ou des appareils agricoles pour disperser les bactéries. Cependant une partie des bactéries ainsi apportées n’arrivent pas sur la plante. Pour remédier à ce problème, des recherches visent à utiliser des abeilles comme moyen de transport pour transmettre ces bactéries directement au niveau des fleurs.
Abeilles sociales et solitaires
Plus de 17 500 espèces d’abeilles ont été décrites par des scientifiques [1]. Parmi celles-ci l’une des plus connues est l’abeille européenne (Apis mellifera) qui a été domestiquée par les humains et vit de façon sociale dans des ruches. On y retrouve, une reine, des mâles et des ouvrières (par exemples butineuses, gardiennes, nourrices).
Au contraire, d’autres abeilles vivent de façon solitaire. C’est le cas des osmies telle que Osmia cornifrons qui est une espèce d’abeille sauvage et solitaire. Elle ne vit pas dans des ruches mais dans des nids formés dans des galeries. Chez cette espèce, il n’y a pas d’abeilles ouvrières mais seulement des mâles et des femelles. L’Osmia cornifrons est connue pour être plus efficace à la pollinisation des pommiers que l’abeille domestique [2].

Osmia cornifrons est originaire du Japon et a été introduite aux États-Unis. Cette abeille mesure 1 cm de long. Dessin inspiré de la photographie Osmia cornifrons d’Alex Surcica
Les abeilles, des vecteurs de micro-organismes ?
Des micro-organismes sont naturellement présents chez les abeilles et forment un microbiote [1]. Celui-ci aide les abeilles à se défendre contre des pathogènes mais également à mieux digérer le pollen. Dans le cas des abeilles sociales, ce microbiote est acquis via les activités sociales et les surfaces de la ruche. Par contre cela n’est pas possible pour les abeilles solitaires qui doivent acquérir leur microbiote à partir des micro-organismes rencontrés dans l’environnement.
En plus du pollen, les fleurs contiennent des micro-organismes pouvant être phytopathogènes, neutres ou bénéfiques pour les pantes. Les abeilles peuvent transporter ces micro-organismes d’une fleur à une autre lorsqu’elles butinent. Le microbiote des abeilles dépend donc des fleurs butinées et des micro-organismes qui s’y trouvent [3 ; 4].

Bactéries bénéfiques pour les plantes
Parmi les micro-organismes apportés par les abeilles, certaines bactéries ont un rôle positif pour les plantes en empêchant le développement de phytopathogènes. L’inhibition du développement des phytopathogènes est expliquée par plusieurs mécanismes [5 ; 6]. Par exemple, les bactéries bénéfiques peuvent stimuler les défenses de la plante pour l’aider à mieux se défendre. Autrement, en se nourrissant des nutriments présents dans les fleurs, ces bactéries réduisent la quantité de nourriture disponible pour les espèces phytopathogènes. On parle de compétition pour la nourriture.

Comment transporter ces bactéries avec des abeilles ?
Une équipe de recherche s’est intéressée à transmettre, aux plantes, ces bactéries via des abeilles. Cette méthode avait déjà été étudiée avec des abeilles sociales [7]. Mais dans cette étude, ce sont des abeilles solitaires qui sont utilisées. Comme ces abeilles ne vivent pas dans une ruche, les scientifiques ont créé un nichoir qui attire ces abeilles et où elles peuvent acquérir les micro-organismes bénéfiques pour la plante. Une partie du nid est recouverte avec la bactérie à transférer. Lorsque l’abeille sort du nichoir, elle entre en contact avec les bactéries et peut ensuite les transmettre.

La bactérie utilisée dans cette étude est Bacillus subtilis QST 713. Cette bactérie est commercialisée depuis l’année 2000 en tant que produit phytosanitaire [8]. Elle est inoffensive pour les humains mais empêche la croissance de mycètes phytopathogènes comme celui responsable du mildiou [6].

Transmission primaire : de l’abeille à la fleur
Dans un premier temps, la transmission des bactéries est testée du nichoir vers les fleurs. Deux nichoirs sont placés dans une serre contenant 14 pommiers sauvages (Malus sylvestris). Puis des abeilles sont laissées butiner pendant 24 heures dans la serre.
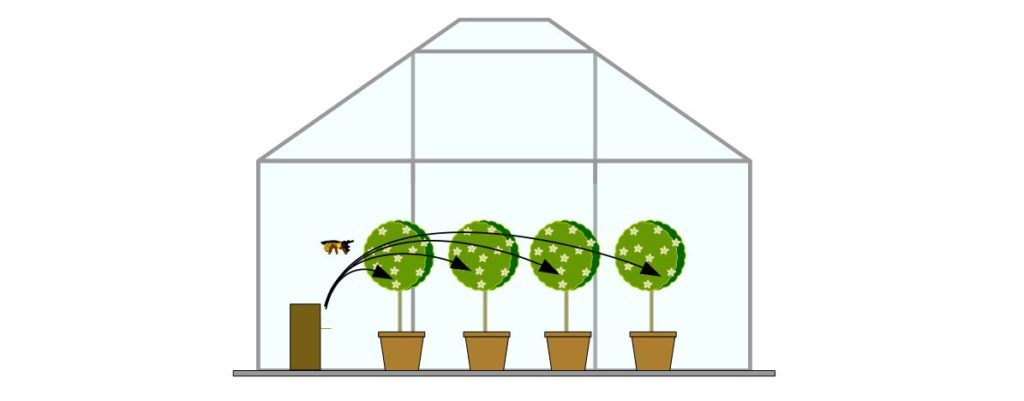
Après 24 heures, 120 fleurs sont prélevées sur ces arbres pour déterminer l’efficacité du traitement. La bactérie Bacillus subtilis QST 713 est détectée dans ces fleurs ce qui indique qu’elle a bien été transmise par les abeilles solitaires.
Transmission secondaire de la fleur à la fleur
Dans un second temps, la transmission de la bactérie d’une fleur à une autre est testée dans la nature. Les plantes utilisées dans la première expérience sont déplacées dans une zone forestière à 8 km de la serre. À côté des pommiers ayant reçu la bactérie lors de la première expérience, de nouveaux pommiers, n’ayant pas subis de traitements, sont déposés. Ces nouveaux pommiers permettront de voir si la bactérie peut être transmise depuis un arbre déjà traité. Dans cette expérience, le nichoir à abeilles n’est pas présent.

Après 24 heures, 120 fleurs sont de nouveau prélevées. Les scientifiques observent alors une augmentation du nombre de bactéries ainsi qu’une transmission aux arbres n’ayant pas été traités dans la serre. Cette augmentation indique que cette espèce de bactérie est capable de survivre dans les fleurs et de se multiplier. Le traitement serait donc capable de s’autorépliquer dans l’environnement ce qui réduit la fréquence de l’opération.
Perspectives de l’étude
Les résultats de cette étude indiquent que les abeilles peuvent être utilisées pour transmettre des bactéries bénéfiques pour les plantes. Ce traitement, en plus de prévenir les maladies, favorise la pollinisation via la présence des abeilles (et des nichoirs). Cependant, cette méthode repose sur de nombreuses variables comme l’espèce d’abeille, les plantes, le nid, les bactéries, … D’autres études seront nécessaires pour mieux comprendre et optimiser ce procédé.
Référence de l’étude
Joshi, N. K., Ngugi, H. K., & Biddinger, D. J. (2020). Bee vectoring: Development of the japanese orchard bee as a targeted delivery system of biological control agents for fire blight management. Pathogens, 9(1), 41. doi:10.3390/pathogens9010041 (lien)
Pour plus d’informations
[1] Voulgari-Kokota, A., McFrederick, Q. S., Steffan-Dewenter, I., & Keller, A. (2019) Drivers, diversity, and functions of the solitary-bee microbiota. Trends in Microbiology, 27(12), 1034 – 1044 (lien)
[2] McKinney, M. I., & Yong-Lak Park, Y.L. (2012). Nesting activity and behavior of Osmia cornifrons (Hymenoptera: Megachilidae) elucidated using videography. Volume 2012 doi.org/10.1155/2012/814097 (lien)
[3] Alger, S. A., Burnham, P. A., & Brody, A. K. (2019) Flowers as viral hot spots: Honey bees (Apis mellifera) unevenly deposit viruses across plant species.PLoS ONE 14(9):e0221800. doi.org/10.1371/journal.pone.0221800 (lien)
[4] McFrederick, Q. S., Thomas, J. M., Neff, J. L., Vuona, H. Q., Russel, K. A., Hale, A. R., & Mueller, U. G. (2017). Flowers and wild megachilid bees share microbes. Microb Ecol 73, 188–200 doi.org/10.1007/s00248-016-0838-1 (lien)
[5] Fira, D., Dimkić, I., Berić, T., Lozo, J., & Stanković, S. (2018) Biological control of plant pathogens by Bacillus species. J. Biotechnol. 285:44‐55. doi:10.1016/j.jbiotec.2018.07.044 (lien)
[6] Panstruga, R., & Kuhn, H. (2019). Mutual interplay between phytopathogenic powdery mildew fungi and other microorganisms. Mol. Plant. Pathol. 20(4):463‐470. doi:10.1111/mpp.12771 (lien)
[7] Vanneste, J. L. (1996). Honey bees and epiphytic bacteria to control fire blight, a bacterial disease of apple and pear. Biocontrol News and Information, 17, 67N-78N. (lien)
[8] Ngugi, H. K., Dedej, S., Delaplane, K. S., Savelle, A. T., & Scherm, H. (2005). Effect of flower-applied Serenade biofungicide (Bacillus subtilis) on pollination-related variables in rabbiteye blueberry. Biological Control, 33(1), 32–38. doi:10.1016/j.biocontrol.2005.01.002 (lien)







Aucun commentaire