À quelle vitesse se déplacent les bactéries ?
Posté : 9 avril 2020 / Mis-à-jour : 7 avril 2024
Temps de lecture : 8 minutes
La mobilité est un facteur important pour la survie des bactéries. Elle permet de se déplacer vers des nutriments, de fuir des molécules toxiques ou des prédateurs, de rencontrer d’autres bactéries ou organismes avec lesquels interagir. Étudier cette mobilité aide à mieux comprendre l’adaptation des bactéries à leur environnement. Parmi les différents modes de mobilité présents chez les bactéries, on peut observer les flagelles qui leur permettent de nager dans un milieu liquide. Comment se passe ce déplacement et quelle est la vitesse de ces bactéries ?
Flagelle et mobilité bactérienne
Le flagelle est une structure cellulaire permettant aux bactéries de se déplacer dans un milieu liquide. Il est composé de trois parties : le filament, le crochet et le corps basal. Le corps basal sert de « moteur » et convertit une énergie chimique (gradient de proton) en une énergie physique (rotation). La partie mobile de ce « moteur » peut tourner à une vitesse de 300 rotations par seconde chez Escherichia coli. Cette rotation est transmise au filament via le crochet qui sert de lien entre ces deux éléments.

La rotation du flagelle, dans le sens contraire aux aiguilles d’une montre, permet de propulser la bactérie en avant. Le principe est similaire à celui d’une hélice qui fait avancer un bateau. Le « moteur » du flagelle peut aussi tourner dans le sens des aiguilles d’une montre. Lorsque le sens de rotation du flagelle s’inverse, cela déséquilibre la bactérie qui va tourner sur elle même et ainsi changer de direction.

Le déplacement d’une bactérie composé d’une répétition de phases de nage puis de changement de directions (culbute). Ce mode de déplacement peut sembler désordonné, à première vue. Cependant, les bactéries sont capables de réguler la durée des phases de nage et de culbute pour s’approcher d’un environnement favorable ou au contraire s’éloigner d’un environnement défavorable : ce mécanisme est appelé chimiotactisme.

Un mécanisme similaire chez toutes les bactéries ?
La recherche en microbiologie a été pendant longtemps très orientée vers les micro-organismes pathogènes pour les humains. Le déplacement bactérien a surtout été étudié chez les entérobactéries pathogènes telles que Escherichia coli et Salmonella Typhimurium. Ce qui est valable pour une partie des bactéries ne l’est pas forcément pour toutes les autres. Chez des bactéries vivant dans d’autres écosystèmes, l’utilisation des flagelles peut varier.
À partir du principe de base du flagelle, plusieurs configurations sont possibles ce qui va influencer la nage. Certaines bactéries possèdent un seul flagelle, d’autres une dizaine tandis que certaines comme Candidatus Ovobacter propellens en possèdent plus de 400. La position des flagelles sur la bactérie peut aussi changer. Le terme ciliature est utilisé pour désigner la position des flagelles.

De nombreux cas particuliers existent et le mode de déplacement de certaines bactéries reste encore mystérieux. Ces modes de déplacement permettent de s’adapter à des environnements différents par exemple des milieux plus ou moins visqueux. C’est notamment le cas de la bactérie marine Magnetococcus marinus MC-1.
Magnetococcus marinus MC-1
La bactérie Magnetococcus marinus MC-1 (M. marinus MC-1) a été isolée dans les eaux de l’estuaire de la rivière Pettaquamscutt (États-Unis, Rhode Island). En plus de posséder des flagelles, cette bactérie possède une structure cellulaire appelée magnétosome lui facilitant le déplacement le long du champ magnétique terrestre entre les sédiments et la colonne d’eau (présente entre le fond et la surface).

M. marinus MC-1 possède deux faisceaux de flagelles présents à l’une de ses extrémités. Ce type de ciliature est appelé bilopotriche. Les faisceaux contiennent chacun sept flagelles et sont entourés par une gaine (glycoprotéine) dont la fonction est encore spéculative. Cette gaine pourrait permettre de limiter les forces de frottements ou alors de protéger les flagelles.
Étude du déplacement de Magnetococcus marinus MC-1
Le mouvement de cette bactérie est étudié dans un tube très fin (capillaire de 200 µm) placé sur une lame de microscope. À l’aide d’un microscope relié à un appareil photo, 400 images par seconde sont prises pour observer le déplacement. Des simulations informatiques sont réalisées pour tester plusieurs modes de déplacement possibles. Ces résultats sont comparés avec ceux obtenus par microscopie pour étudier ceux qui correspondent le plus à ce qui est observé.
Résultats de l’étude
L’étude confirme que la vitesse de M. marinus MC-1 peut atteindre 500 µm.s−1. Cette vitesse est supérieure à celle de nombreuses bactéries. Par exemple, la souche modèle de laboratoire, Escherichia coli possède une vitesse d’environ 10 µm.s−1.
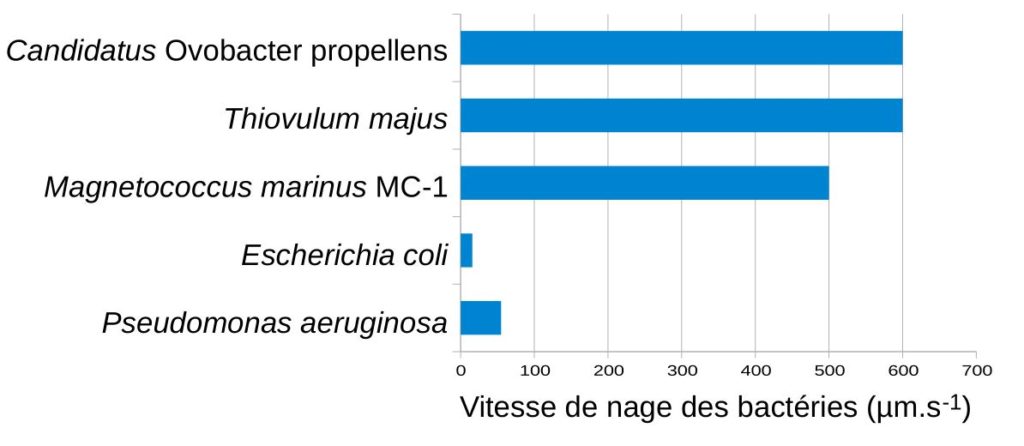
Pour mieux se rendre compte de la vitesse, à cette échelle microscopique, il est possible d’indiquer la distance comparée à la taille de la cellule. Dans le cas de M. marinus MC-1, la vitesse est de 200 fois la distance du corps par seconde. C’est-à-dire qu’en une seconde, elle est capable de réaliser un mouvement 200 fois supérieur à la taille de son corps (1 à 2 µm).

Comparaison de la vitesse avec d’autres cellules
Les bactéries ne sont pas les seuls organismes à posséder des flagelles. On retrouve des flagelles chez des cellules comme les dinoflagellés ou les spermatozoïdes. Mais malgré un nom similaire ces structures fonctionnement de façon différente. Par exemple le flagelle d’un spermatozoïde a un mouvement ondulatoire contrairement aux bactéries chez qui les flagelles ont un mouvement rotatif (comme une hélice). La vitesse de quelques cellules est indiquée ci-dessous pour comparer à celles des bactéries.

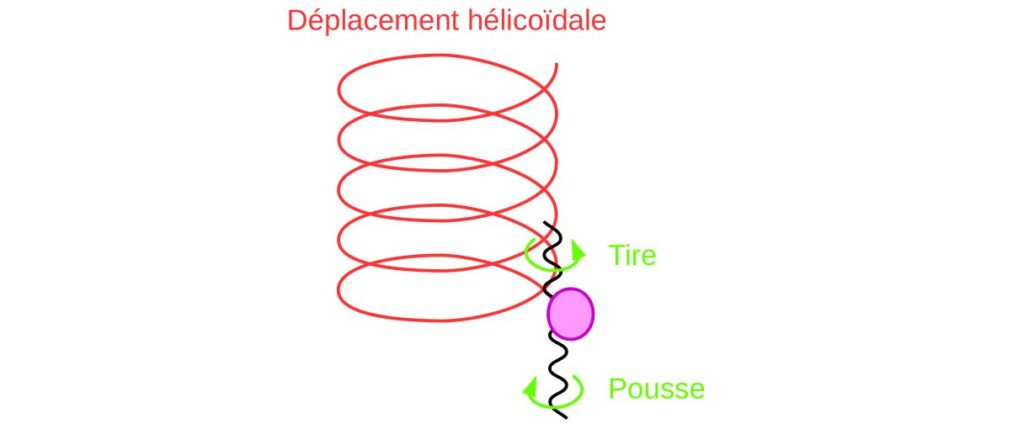
Mécanisme de déplacement de Magnetococcus marinus MC-1
L’étude de La mobilité de M. marinus MC-1 indique que les deux faisceaux de flagelles de cette bactérie auraient des rôles différents. L’un permettrait de tirer la bactérie tandis que l’autre la pousse. Pour cela, l’un tournerait dans le sens des aiguilles d’une montre et l’autre dans un sens contraire. C’est la coordination entre ces deux mécanismes qui permet d’obtenir un mouvement efficace. Ainsi la bactérie peut se déplacer en formant une spirale.
Perspectives de l’étude
Cette étude a permis de décrire un nouveau mode de déplacement bactérien. Ces résultats serviront à mieux comprendre l’adaptation de cette bactérie à son écosystème.
En plus des applications en microbiologie, la compréhension de ces mécanismes pourrait aussi être utilisée pour la conception de robots à l’échelle microscopique. Ceux-ci sont construits pour des usages médicaux : cibler une tumeur, délivrer un médicament de façon précise, … Des applications dans le domaine de la dépollution sont aussi possibles pour détecter ou dégrader des polluants avec ces robots microscopiques.
Référence de l’étude
Bente, K., Mohammadinejad, S., Charsooghi, M. A., Bachmann, F., Codutti, A., Lefèvre, C. T., Klumpp, S. & Faivre, D. (2020) High-speed motility originates from cooperatively pushing and pulling flagella bundles in bilophotrichous bacteria. Elife. 2020 Jan 28;9. pii: e47551. doi: 10.7554/eLife.47551. (lien)
Pour plus d’informations
Bazylinski, D. A., Williams, T. J., Lefevre, C. T., Berg, R. J., Zhang, C. L., Bowser, S. S., Dean, A. J. & Beveridge, T. J. (2012). Magnetococcus marinus gen. nov., sp. nov., a marine, magnetotactic bacterium that represents a novel lineage (Magnetococcaceae fam. nov., Magnetococcales ord. nov.) at the base of the Alphaproteobacteria. International journal of systematic and evolutionary microbiology, 63(Pt 3), 801–808. doi:10.1099/ijs.0.038927-0 (lien)
Bishop, D. W. (1962). Sperm motility. Physiological Reviews, 42(1), 1–59. doi:10.1152/physrev.1962.42.1.1 (lien)
Bonini, N. M. (1988). Differential regulation of Paramecium ciliary motility by cAMP and cGMP. The Journal of Cell Biology, 106(5), 1615–1623. doi:10.1083/jcb.106.5.1615 (lien)
Fenchel, T., & Thar, R. (2004). Candidatus Ovobacter propellens: a large conspicuous prokaryote with an unusual motility behaviour. FEMS Microbiology Ecology, 48(2), 231–238. doi:10.1016/j.femsec.2004.01.013 (lien)
Garcia-Pichel, F. (1989). Rapid bacterial swimming measured in swarming cells of Thiovulum majus. Journal of Bacteriology, 171(6), 3560–3563. doi:10.1128/jb.171.6.3560-3563.1989 (lien)
Hand, W. G., Collard, P. A., & Davenport, D. (1965). The effects of temperature and salinity change on swimming rate in the Dinoflagellates, Gonyaulax and Gyrodinium. The Biological Bulletin, 128(1), 90–101. doi:10.2307/1539392 (lien)
Lefèvre, C. T., Santini, C.-L., Bernadac, A., Zhang, W.-J., Li, Y., & Wu, L.-F. (2010). Calcium ion-mediated assembly and function of glycosylated flagellar sheath of marine magnetotactic bacterium. Molecular Microbiology, 78(5), 1304–1312. doi:10.1111/j.1365-2958.2010.07404.x (lien)
Mushtaq, F., Asani, A., Hoop, M., Chen, X.-Z., Ahmed, D., Nelson, B. J., & Pané, S. (2016). Highly efficient coaxial TiO2-PtPd tubular nanomachines for photocatalytic water purification with multiple locomotion strategies. Advanced Functional Materials, 26(38), 6995–7002. doi:10.1002/adfm.201602315 (lien)
Nakamura, S., & Minamino, T. (2019). Flagella-driven motility of bacteria. Biomolecules, 9(7), 279. doi:10.3390/biom9070279 (lien)
Quelas, J. I., Althabegoiti, M. J., Jimenez-Sanchez, C., Melgarejo, A. A., Marconi, V. I., Mongiardini, E. J., Mengucci, F., Ortega-Calvo, J.J., & Lodeiro, A. R. (2016). Swimming performance of Bradyrhizobium diazoefficiens is an emergent property of its two flagellar systems. Scientific Reports, 6(1). doi:10.1038/srep23841 (lien)
Ojakian, G. K., & Katz, D. F. (1973). A simple technique for the measurement of swimming speed of Chlamydomonas. Experimental Cell Research, 81(2), 487–491. doi:10.1016/0014-4827(73)90540-5 (lien)







2 Commentaires
La majorité des organismes vivants est incapable de détecter le champ magnétique terrestre. Néanmoins certaines bactéries (dites magnétotactiques) sont capables de le faire via des structures appelées magnétosomes contenant des cristaux de fer [1 - 2]. Ces magnétosomes agissent comme des « boussoles » permettant de s’orienter le long du champ magnétique terrestre. Ainsi les magnétosomes de la bactérie Magnetospirillum gryphiswaldense sont capables de fonctionner jusqu’à une intensité de 30 mT ce qui correspond à environ 500 fois le champ magnétique terrestre (allant de 50 à 60 µT) [2]. Pour comparaison un aimant comme ceux utilisés pour les frigos a un champ magnétique d’environ 1 mT et un IRM peut aller jusqu’à 10 T.
Les champs magnétiques dits basses fréquences sont compris entre 0 et 10 kHz (la définition de cette gamme de fréquence varie légèrement d’une source à l’autre) et correspond notamment aux champs émis par les appareils électriques (la fréquence du courant est de 50 Hz en Europe) et les lignes à haute tension. Les champs magnétiques émis par les appareils électroniques du quotidien comme des sèches-cheveux, horloges électriques ou machine à coudre ont une faible intensité (quelques dizaines de µT) et ont donc un ordre de grandeur similaire à celui du champ la Terre [3]. Cette intensité diminue rapidement avec la distance lorsque l’on s’éloigne de l’appareil électrique qui émet le champ magnétique.
Plusieurs études ont eu lieu sur le déplacement de bactéries magnétotactique dans un champ magnétique à basse fréquence. Une étude indique que la bactérie magnétotactique Magnetospirillum gryphiswaldense est capable de se réorienter dans un champ magnétique avec une fréquence de 0,45 Hz et une intensité de 1 mT [4]. Un champ magnétique à basse fréquence est utilisé pour ralentir la bactérie Magnetospirillum magnetotacticum MS-1 et l’aider à se positionner dans le cadre d’applications en robotique / biotechnologie [5].
Pour les micro-organismes sans magnétosomes tels que des paramécies et des diatomées, plusieurs études ont eu lieu sur le déplacement dans des champs magnétiques à basses fréquences [6 - 8]. Ces études ne montrent aucunes modifications de la mobilité dans ces champs.
Les champs magnétiques à basses fréquences pourraient avoir d’autres effets sur les micro-organismes mais les résultats scientifiques à cette question sont assez controversés et varient selon les études [9 - 10]. Cela pourrait être dû à de nombreux paramètres comme les micro-organismes utilisés qui changent, les caractéristiques physiques du champ magnétique, les conditions d’études ou à des faiblesses des protocoles expérimentaux / analyses statistiques. Des études avec des protocoles plus standardisés seront nécessaires pour tirer des conclusions sur ce sujet. En attendant, il faut faire très attention lors de l’analyse de ces résultats et ne pas émettre des conclusions trop hatives.
[1] Goswami, P., He, K., Li, J., Pan, Y., Roberts, A. P., & Lin, W. (2022). Magnetotactic bacteria and magnetofossils: ecology, evolution and environmental implications. NPJ biofilms and microbiomes, 8(1), 43. doi.org/10.1038/s41522-022-00304-0
[2] Körnig, A., Dong, J., Bennet, M., Widdrat, M., Andert, J., Müller, F. D., Schüler, D., Klumpp, S., & Faivre, D. (2014). Probing the mechanical properties of magnetosome chains in living magnetotactic bacteria. Nano letters, 14(8), 4653–4659. doi.org/10.1021/nl5017267
[3] Kaune, W. T., Miller, M. C., Linet, M. S., Hatch, E. E., Kleinerman, R. A., Wacholder, S., … & Haines, C. (2002). Magnetic fields produced by hand held hair dryers, stereo headsets, home sewing machines, and electric clocks. Bioelectromagnetics: Journal of the Bioelectromagnetics Society, The Society for Physical Regulation in Biology and Medicine, The European Bioelectromagnetics Association, 23(1), 14-25. doi.org/10.1002/bem.94
[4] Ērglis, K., Wen, Q., Ose, V., Zeltins, A., Sharipo, A., Janmey, P. A., & Cēbers, A. (2007). Dynamics of magnetotactic bacteria in a rotating magnetic field. Biophysical journal, 93(4), 1402-1412. doi.org/10.1529/biophysj.107.107474
[5] Khalil, I. S., Pichel, M. P., Abelmann, L., & Misra, S. (2013). Closed-loop control of magnetotactic bacteria. The International Journal of Robotics Research, 32(6), 637-649. doi.org/10.1177/0278364913479412
[6] Nakaoka, Y., Takeda, R., & Shimizu, K. (2002). Orientation of paramecium swimming in a DC magnetic field. Bioelectromagnetics, 23(8), 607–613. doi.org/10.1002/bem.10059
[7] Guevorkian, K., & Valles, J. M., Jr (2006). Aligning Paramecium caudatum with static magnetic fields. Biophysical journal, 90(8), 3004–3011. doi.org/10.1529/biophysj.105.071704
[8] Clarkson, N., Davies, M. S., & Dixey, R. (1999). Diatom motility and low frequency electromagnetic fields--a new technique in the search for independent replication of results. Bioelectromagnetics, 20(2), 94–100. doi.org/10.1002/(sici)1521-186x(1999)20:2<94::aid-bem3>3.0.co;2-q
[9] Fojt, L., Strasák, L., Vetterl, V., & Smarda, J. (2004). Comparison of the low-frequency magnetic field effects on bacteria Escherichia coli, Leclercia adecarboxylata and Staphylococcus aureus. Bioelectrochemistry (Amsterdam, Netherlands), 63(1-2), 337–341. doi.org/10.1016/j.bioelechem.2003.11.010
[10] Woroszyło, M., Ciecholewska-Juśko, D., Junka, A., Pruss, A., Kwiatkowski, P., Wardach, M., & Fijałkowski, K. (2021). The impact of intraspecies variability on growth rate and cellular metabolic activity of bacteria exposed to rotating magnetic field. Pathogens, 10(11), 1427. doi.org/10.3390/pathogens10111427