Les bactéries peuvent-elles dégrader les PFAS ?
Posté : 14 octobre 2025 / Mis-à-jour : 14 octobre 2025
Temps de lecture : 7 minutes
Les PFAS (per- and polyfluoroalkyl substances ou substances perfluoroalkylées et polyfluoroalkylées en français) considérés comme des polluants éternels font parler d’eux depuis plusieurs années [1]. Cette famille regroupant plus de 10 000 composés produits par les activités humaines (industrie) sont retrouvés dans l’environnement où ils posent problème de par leur toxicité. Ces polluants sont détectés fréquemment dans la nourriture, l’eau potable, et même dans le sang ou le placenta humain. Les micro-organismes peuvent-ils dégrader ces polluants ?
Image à ajouter = Capture d’écrans d’articles de presses
C’est quoi les PFAS
Les PFAS sont une famille de molécules assez diverse mais qui possède la caractéristique commune de posséder aux moins deux atomes de fluor liés au même carbone dans leur structure chimique.
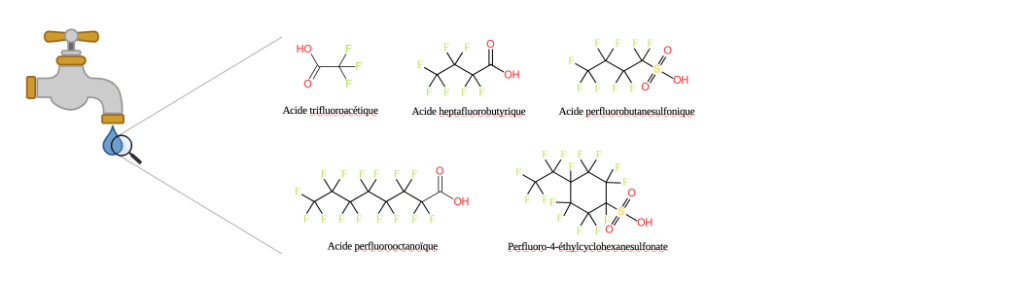
Exemples de PFAS retrouvés dans l’eau du robinet.
Certains PFAS sont connus pour leur toxicité tels que le PFOA (Acide perfluorooctanoïque) ou le PFOS (Acide perfluorooctanesulfonique). Ceux ci ont vu leur utilisation réduite suite aux conventions de Stockholm sur les polluants organiques persistants de 2009 et 2019. Les alcools fluorotélomères, tel que l’alcool fluorotélomère 6:2 (FTOH 6:2), sont depuis utilisées pour remplacer ces substances. Ils servent notamment de précurseurs pour la synthèse de nombreuses autres PFAS. Mais ces molécules sont aussi trouvées dans l’environnement suite à leur utilisation par les activités humaines.
Image à ajouter = Structure chimique des alcools fluorotélomères (4:2 et 6:2). Les nombres dans leur nom font références aux atomes avec uniquement ou sans liaisons carbone – fluor. Ainsi pour l’alcool fluorotélomère 6:2, il y a 6 atomes avec uniquement des liaisons carbone – fluor et 2 sans.
Alcools fluorotélomères dans l’environnement
Les humains sont fortement exposés à ces molécules. En effet, ces PFAS sont les plus retrouvés dans l’air intérieur. Ainsi ils ont été trouvés dans des chambre d’enfants en Finlande ou dans des écoles maternelles en Californie [2-3]. Sachant que l’on reste 80 à 90 % de sa journée à l’intérieur exposé à ces polluants.
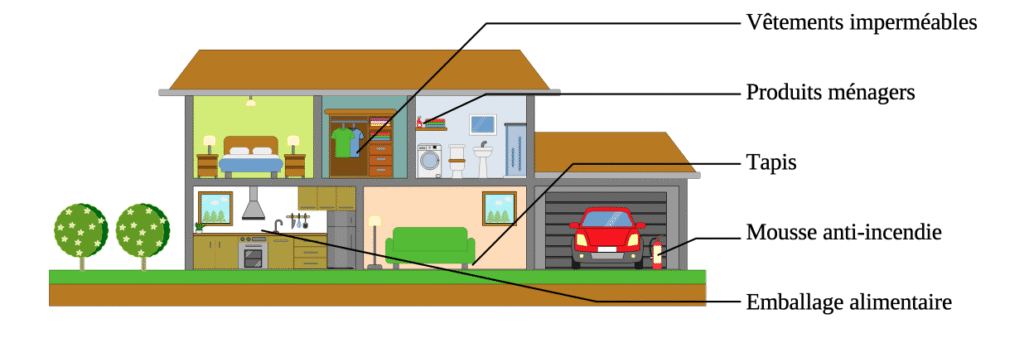
De plus ils sont aussi retrouvés dans des objets du quotidien comme des vestes imperméables ou les emballages alimentaires ainsi que dans l’eau du robinet [4-5].
Toxicité des alcools fluorotélomères
Il y a actuellement peu d’études pour l’alcool fluorotélomère 6:2 chez l’humain. Les données existantes sont pour des rats et souris de laboratoires [6]. Chez ces animaux des troubles du système reproducteurs sont détectés. Une fois ingéré via l’eau ou des poussières, cette substance peut être transformée en d’autres composés tels que des acides perfluorocarboxyliques qui sont aussi toxiques.
Biodégradation du FTOH 6:2 par des micro-organismes
Comme les autres PFAS, l’alcool fluorotélomère 6:2 est difficilement dégradé par les micro-organismes. Ce qui conduit à son accumulation dans l’environnement. Néanmoins, son métabolisme a été observé dans plusieurs environnement comme des sols, des sédiments ou des boues de stations d’épurations. Plusieurs organismes sont connus pour intervenir dans la transformation de ce produit, comme les bactéries Pseudomonas butanovora et Pseudomonas oleovorans ou le champignon Phanerochaete chrysosporium [7-8]. Mais cette biodégradation est incomplète et conduit à la formation d’autres PFAS tels que l’acide trifluoroacétique ou des acides perfluorocarboxyliques qui sont tout aussi problématiques dans l’environnement [9]. Bien comprendre ces vois de transformations est important pour connaître le devenir de ce polluant dans l’environnement.
Une nouvelle souche bactérienne pour dégrader le FTOH 6:2 ?
Pour mieux comprendre le métabolisme de l’alcool fluorotélomère 6:2, une équipe australienne de scientifiques a isolé une bactérie du liquide percolant (lixiviat) entre les déchets d’une décharge polluée par plusieurs PFAS [10]. Cette souche bactérienne appelée J3 est capable de se développer en utilisant un PFAS le sulfonate de fluorotélomère 6:2 comme seule source de soufre. Son génome a été séquencé ce qui a permis de la rapprocher de Dietzia aurantiaca CCUG 35676T et de créer une nouvelle souche.
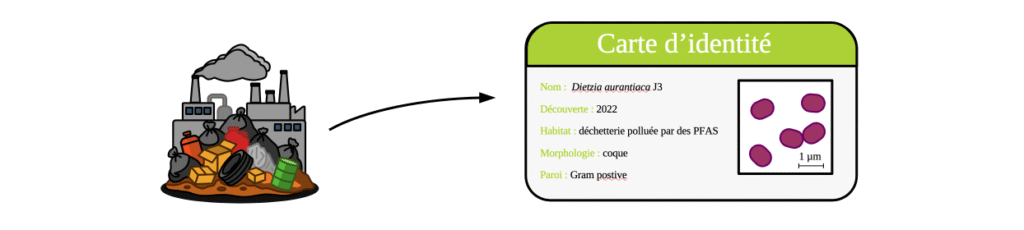
Cette bactérie a été cultivée dans des milieux de culture contenant du FTOH 6:2 ou du FTOH 4:2. Après six jours de cultures, ces polluants ont été partiellement transformés : 80 % du FTOH 6:2 et 58 % du FTOH 4:2. D’autres analyses ont permis de montrer que seulement 6 à 14 % des atomes de fluors ont été détachés de ces molécules et libérés dans le milieu de culture. Cela signifie que la dégradation est incomplète ce qui est confirmée par l’étude des métabolites produits. Ceux-ci ont perdu en moyenne un à deux atome(s) de fluor (mais en gardent toujours). Donc ces deux molécules sont « grignotées » mais pas complétement dégradées, les produits obtenus restent des PFAS. C’est la première observation de la biotransformation du FTOH 4:2 par une culture pure.
Pour mieux comprendre cette transformation, les enzymes produites ont été recherchées par une étude de protéomique (c’est-à-dire de l’ensemble de protéine de la cellule). Une surproduction de protéines impliquées dans la voie métabolique de la beta-oxydation des acides gras a été mise en évidence. Parmi les intermédiaires détectés, une nouvelle voie métabolique impliquant une conjugaison avec du glutathion a été découverte. Elle correspond à un mécanisme connu de détoxification par les enzymes glutathion S transférase (GST).
Image à ajouter = schéma simplifié voie métabolique.
Les produits de transformations peuvent être dégradés par d’autres micro-organismes dans l’environnement mais à des rythmes très longs.
Perspectives de l’étude
Les PFAS ne semblent donc pas être des polluants aussi éternels que ce que l’on entend mais leur dégrdatation est lente et incomplète. Ce métabolisme est peu courant et peut prendre plusieurs semaines / mois ce qui limite son utilisation en bioréhabilitation.
Comprendre comment des bactéries tels que Dietzia aurantiaca J3 métabolise ce polluant permettra de mieux suivre ce composé et ses dérivés dans l’environnement. De plus cette nouvelle voie métabolique pourrait ouvrir des opportunités en bioréhabilitation. Mais les conditions pour son utilisation à grande échelles ne sont pas atteintes. En attendant de pouvoir dégrader ces polluants, leur utilisation pourrait être réduite ou interdite pour limiter les effets sur l’environnement et la santé humaine.
Référence de l’étude
Bhardwaj, S., Lee, M., O’Carroll, D., McDonald, J., Osborne, K., Khan, S., Pickford, R., Coleman, N., O’Farrell, C., Richards, S., & Manefield, M. J. (2024). Biotransformation of 6:2/4:2 fluorotelomer alcohols by Dietzia aurantiaca J3: Enzymes and proteomics. Journal of hazardous materials, 478, 135510. doi.org/10.1016/j.jhazmat.2024.135510 (lien)
Bibliographie complémentaire
[1] Gaines, L. G., Sinclair, G., & Williams, A. J. (2023). A proposed approach to defining per‐and polyfluoroalkyl substances (PFAS) based on molecular structure and formula. Integrated Environmental Assessment and Management, 19(5), 1333-1347. (lien)
[2] Winkens, K., Koponen, J., Schuster, J., Shoeib, M., Vestergren, R., Berger, U., … & Cousins, I. T. (2017). Perfluoroalkyl acids and their precursors in indoor air sampled in children’s bedrooms. Environmental Pollution, 222, 423-432. (lien)
[3] Morales-McDevitt, M. E., Becanova, J., Blum, A., Bruton, T. A., Vojta, S., Woodward, M., & Lohmann, R. (2021). The air that we breathe: Neutral and volatile PFAS in indoor air. Environmental science & technology letters, 8(10), 897-902. (lien)
[4] Eichler, C. M., Davern, M. J., Surratt, J. D., Morrison, G. C., & Turpin, B. J. (2024). Fluorotelomer alcohol (FTOH) emission rates from new and old rain jackets to air determined by iodide high-resolution chemical ionization mass spectrometry. Indoor Environments, 1(4), 100055. (lien)
[5] Habib, A., Landa, E. N., Holbrook, K. L., Walker, W. S., & Lee, W. Y. (2023). Rapid, efficient, and green analytical technique for determination of fluorotelomer alcohol in water by stir bar sorptive extraction. Chemosphere, 338, 139439. (lien)
[6] Rice, P. A., Aungst, J., Cooper, J., Bandele, O., & Kabadi, S. V. (2020). Comparative analysis of the toxicological databases for 6: 2 fluorotelomer alcohol (6: 2 FTOH) and perfluorohexanoic acid (PFHxA). Food and Chemical Toxicology, 138, 111210.
[7] Kim, M. H., Wang, N., & Chu, K. H. (2014). 6: 2 Fluorotelomer alcohol (6: 2 FTOH) biodegradation by multiple microbial species under different physiological conditions. Applied microbiology and biotechnology, 98(4), 1831-1840. (lien)
[8] Merino, N., Wang, N., Gao, Y., Wang, M., & Mahendra, S. (2023). Roles of various enzymes in the biotransformation of 6:2 fluorotelomer alcohol (6:2 FTOH) by a white-rot fungus. Journal of hazardous materials, 450, 131007. doi.org/10.1016/j.jhazmat.2023.131007 (lien)
[9] Sun, M., Cui, J., Guo, J., Zhai, Z., Zuo, P., & Zhang, J. (2020). Fluorochemicals biodegradation as a potential source of trifluoroacetic acid (TFA) to the environment. Chemosphere, 254, 126894. doi.org/10.1016/j.chemosphere.2020.126894 (lien)
[10] Méndez, V., Holland, S., Bhardwaj, S., McDonald, J., Khan, S., O’Carroll, D., Pickford, R., Richards, S., O’Farrell, C., Coleman, N., Lee, M., & Manefield, M. J. (2022). Aerobic biotransformation of 6:2 fluorotelomer sulfonate by Dietzia aurantiaca J3 under sulfur-limiting conditions. The Science of the total environment, 829, 154587. doi.org/10.1016/j.scitotenv.2022.154587 (lien)
Jin, H., Mao, L., Xie, J., Zhao, M., Bai, X., Wen, J., … & Wu, P. (2020). Poly-and perfluoroalkyl substance concentrations in human breast milk and their associations with postnatal infant growth. Science of the Total Environment, 713, 136417.







Aucun commentaire