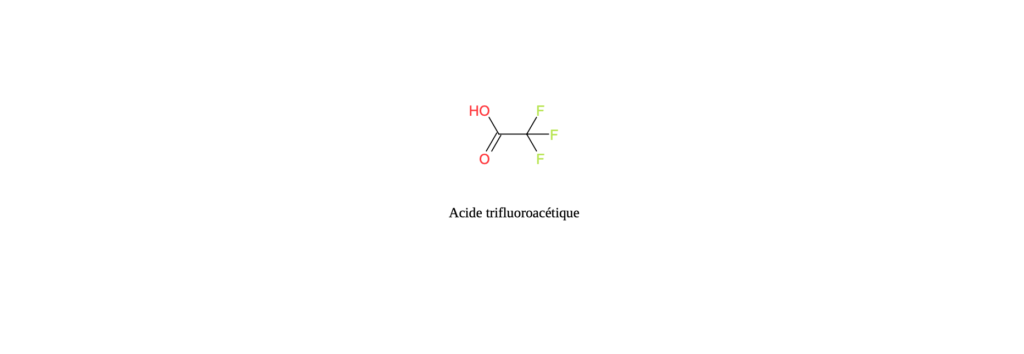
Acide trifluoroacétique
Définition
L’acide trifluoroacétique est un polluant appartenant à la famille des PFAS (per- and polyfluoroalkyl substances). Cette molécule est très soluble dans l’eau ainsi que très résistante à la biodégradation de part la présence de liaisons carbone-fluor (-CF3). Ces propriétés conduisent à son accumulation dans l’environnement [1]. Il s’agit du PFAS le plus fréquemment détecté dans l’environnement.
Sources d’acide trifluoroacétique
Sources naturelles
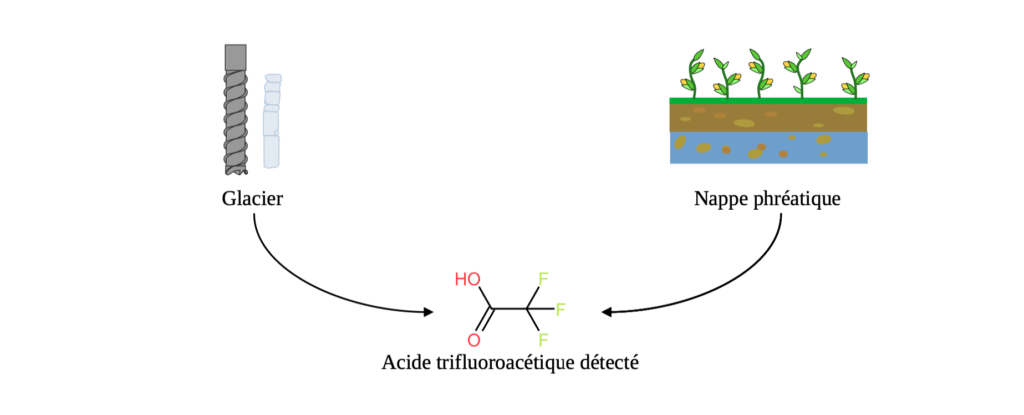
La production naturelle d’acide trifluoroacétique fait débat dans la communauté scientifique [2]. Ce composé pourrait être produit naturellement au niveau des océans mais aucun mécanisme de formation n’est connu. Il a été détecté dans certaines nappes phréatiques ou glaciers dans des prélèvements non contaminés (datant d’époques antérieures à son industrialisation). Néanmoins certains de ces résultats sont sujets à des artefacts liés aux méthodes de mesures ou à des contaminations remettant en cause sa production naturelle.
Sources humaines
La principale source d’émission d’acide trifluoroacétique dans l’environnement est son utilisation comme réactif dans l’industrie (notamment comme solvant et pour la synthèse d’autres PFAS) ainsi qu’en agriculture (pesticides) [3].
En plus de cette source primaire, il peut aussi provenir de sources secondaires comme la dégradation d’autres composés. En effet, plusieurs milliers de substances sont connues comme capables de produire du TFA lors de leur dégradation :
- Dégradation dans l’atmosphère. Le 1,1,1,2-Tétrafluoroéthane, un fluide réfrigérant utilisé pour les réfrigérateurs et climatisations, réagit dans l’atmosphère pour former du TFA.
- Biodégradation par des micro-organismes. Les alcools fluorotélomères (4:2 et 6:2) qui sont utilisés pour la synthèse de nombreux produits (peinture, packaging alimentaire, matériel électronique, …) peuvent être biodégradés par des micro-organismes en TFA [4].
- Biodégradation dans le corps humain. L’utilisation d’halothane, un gaz anesthésique, conduit à la formation de TFA dans le corps humain. Cet anesthésiant a été retiré du commerce à cause de sa toxicité qui peut être liée au TFA.
Exposition à l’acide trifluoroacétique
Les rejets industriels conduisent à l’accumulation de ce polluant dans l’environnement. De nombreux fleuves et nappes phréatiques sont contaminés par le TFA.
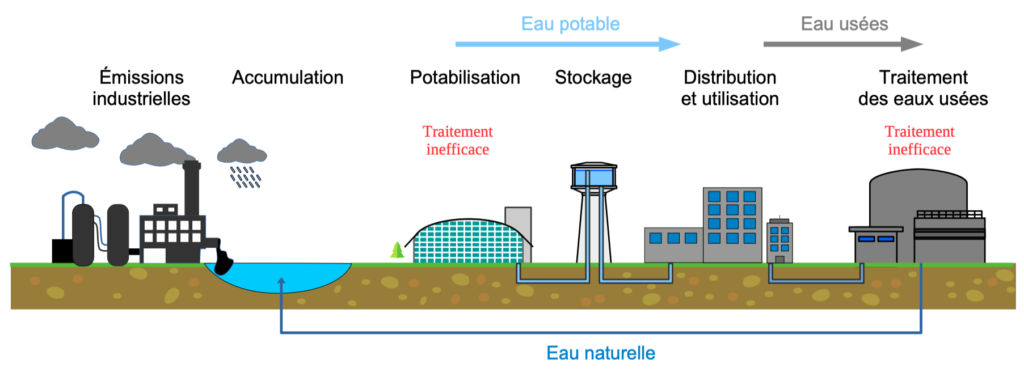
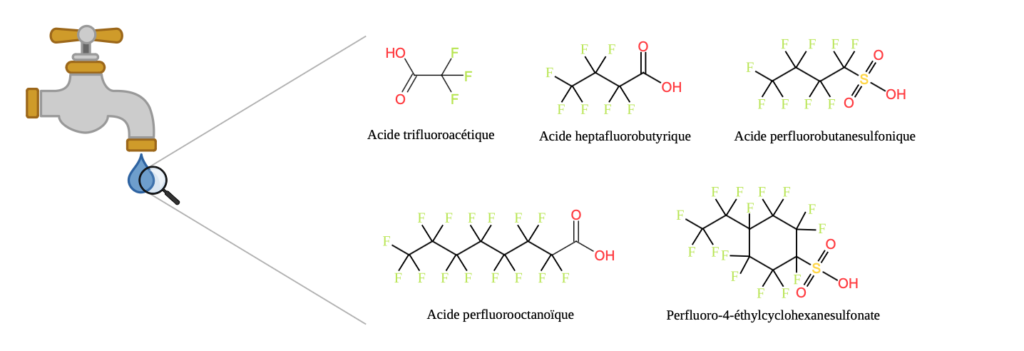
Comme ce polluant est difficilement éliminé lors de la potabilisation de l’eau, il est détecté dans l’eau du robinet [5]. Il est également retrouvé dans des plantes consommées par les humains.
Toxicité de l’acide trifluoroacétique
L’acide trifluoroacétique a été démontré comme toxique pour plusieurs organismes aquatiques tel que Raphidocelis subcapitata, une espèce de micro-algue [6].
Pour les humains, lorsqu’il est ingéré via l’eau, il se retrouve rapidement dans le sang ce qui lui permet de circuler dans tout le corps (et même de franchir la barrière du placenta). Ce qui explique que ce composé soit détecté dans l’organisme humain lors de prélèvements de sang ainsi que dans l’urine.
Il semble peu toxique pour le corps humain et serait excrété via l’urine. Néanmoins, il y a peu d’études sur la toxicité chez l’humain et notamment sur son impact à long terme ou sur un effet cocktail avec d’autres polluants. Les données étant limitées, de nouvelles études sont nécessaires pour définir sa toxicité (ou son absence).
A fortes concentrations, cet acide peut provoquer des brulures chimiques sévères [7].
Élimination de l’acide trifluoroacétique
Ce polluant est très stable et persiste longtemps dans l’environnement. Il est difficilement éliminé dans les stations de traitement des eaux usées. Plusieurs méthodes physico-chimiques tels que des filtrations ou des photodégradations sont mises en place pour l’éliminer (mais restent à une échelle expérimentale).
Plusieurs études indiquent que ce polluant peut être dégradé par des micro-organismes. Mais ceux-ci et les voies métaboliques impliquées ne sont pas connus avec précision ce qui limite leur utilisation à l’échelle industrielle pour la bioréhabilitation.
En l’absence de méthodes efficaces pour dégrader ce polluant, il continue de s’accumuler dans l’environnement ce qui pourrait représenter un problème si des effets négatifs ou toxicité étaient découverts dans le futur.
Première étude de biodégradation
La première étude sur sa biodégradation date de 1994 et correspond à l’utilisation d’une communauté microbienne provenant d’un pré-salé (aussi appelé schorre) [8].
Lors de cette expérience, l’utilisation de l’acide trifluoroacétique marqué avec un radio-isotope (14C) a permis d’observer la production de plusieurs molécules lors de sa biodégradation. En condition aérobie, du trifluorométhane est produit tandis qu’en anaérobie du méthane est produit. Les étapes intermédiaires entre l’acide trifluoroacétique et ces produits ne sont pas connues. Ces résultats obtenus au laboratoire ne sont pas forcément reproductibles à l’échelle industrielle.
Études plus récentes
D’autres études ont par la suite montré sa biodégradation (ou non) par des communautés microbiennes provenant de plusieurs environnements différents [9]. Néanmoins la biodégradation reste limitée et il n’y a pas encore d’applications à grande échelle.
Références bibliographiques
[1] Arp, H. P. H., Gredelj, A., Glüge, J., Scheringer, M., & Cousins, I. T. (2024). The global threat from the irreversible accumulation of trifluoroacetic acid (TFA). Environmental science & technology, 58(45), 19925–19935. doi.org/10.1021/acs.est.4c06189 (lien)
[2] Joudan, S., De Silva, A. O., & Young, C. J. (2021). Insufficient evidence for the existence of natural trifluoroacetic acid. Environmental Science: Processes & Impacts, 23(11), 1641-1649. doi.org/10.1039/D1EM00306B (lien)
[3] Joerss, H., Freeling, F., van Leeuwen, S., Hollender, J., Liu, X., Nödler, K., … & Sigmund, G. (2024). Pesticides can be a substantial source of trifluoroacetate (TFA) to water resources. Environment International, 193, 109061. doi.org/10.1016/j.envint.2024.109061 (lien)
[4] Sun, M., Cui, J., Guo, J., Zhai, Z., Zuo, P., & Zhang, J. (2020). Fluorochemicals biodegradation as a potential source of trifluoroacetic acid (TFA) to the environment. Chemosphere, 254, 126894. doi.org/10.1016/j.chemosphere.2020.126894 (lien)
[5] Sadia, M., Nollen, I., Helmus, R., Ter Laak, T. L., Béen, F., Praetorius, A., & van Wezel, A. P. (2023). Occurrence, fate, and related health risks of PFAS in raw and produced drinking water. Environmental Science & Technology, 57(8), 3062-3074. doi.org/10.1021/acs.est.2c06015 (lien)
[6] Solomon, K. R., Velders, G. J., Wilson, S. R., Madronich, S., Longstreth, J., Aucamp, P. J., & Bornman, J. F. (2016). Sources, fates, toxicity, and risks of trifluoroacetic acid and its salts: Relevance to substances regulated under the Montreal and Kyoto Protocols. Journal of Toxicology and Environmental Health, Part B, 19(7), 289-304. doi.org/10.1080/10937404.2016.1175981 (lien)
[7] Rochlin, D. H., Rajasingh, C. M., Karanas, Y. L., & Davis, D. J. (2018). Full-thickness chemical burn from trifluoroacetic acid: A case report and review of the literature. Annals of plastic surgery, 81(5), 528–530. doi.org/10.1097/SAP.0000000000001579 (lien)
[8] Visscher, P. T., Culbertson, C. W., & Oremland, R. S. (1994). Degradation of trifluoroacetate in oxic and anoxic sediments. Nature, 369(6483), 729-731. (lien)
[9] Ellis, D. A., Hanson, M. L., Sibley, P. K., Shahid, T., Fineberg, N. A., Solomon, K. R., … Mabury, S. A. (2001). The fate and persistence of trifluoroacetic and chloroacetic acids in pond waters. Chemosphere, 42(3), 309–318. doi:10.1016/s0045-6535(00)00066-7 (lien)